生体防御の最前線においては、免疫系を中心とする細胞表面受容体群と、その相手となる分子との激しいやり取りが交わされています。 相手となる分子としては、腫瘍細胞・ウイルス感染細胞・感染微生物そのもの(ウイルスなど)の表面抗原蛋白質が挙げられます。 これらの細胞間コミュニケーションは、引き続いて起こるシグナル伝達経路の開始点となっており、細胞表面で起こる現象を明らかにし、人為的に制御することで、自己免疫疾患やがん、感染症を克服する特異性の高い免疫制御が可能になると期待しています。
(1)ペア型受容体(LILR、KIR, PILRなど)
非常に相同性の高い細胞外ドメイン(リガンド認識部位)を持ちながら、細胞内に抑制性シグナルを伝達するモチーフ(immunoreceptortyrosine-based inhibitory motif:ITIM) を持つ抑制型受容体と活性化シグナルを伝達するモチーフ(immunoreceptortyrosine-based activation motif:ITAM)を持つ活性型受容体の相反するシグナル伝達能を持つ受容体群のことをペア型受容体と呼びます。 ペア型受容体は、免疫系の細胞表面に多く存在し、実際の免疫機能はこれらペア型受容体群のシグナル伝達のバランスによって決定されると考えられています。
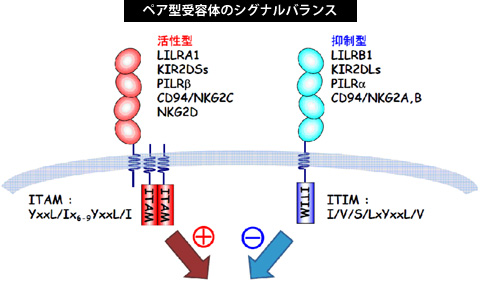
当研究室では以下のペア型受容体群に主に着目し、その分子機能と構造を明らかにしようとしています。
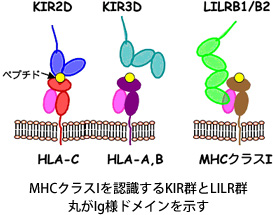
(1)一部のファミリー分子がヒト主要組織適合性複合体(MHC)クラスIを認識することがわかっているものの、
多くのファミリー分子のリガンド・機能が未だ明らかになっていない Leukocyte
Immunoglobulin-Like Receptor (LILR)
(2)同じくMHCクラスIを認識するが、ペプチド依存性を示し、疾患との関連も報告されている
Killer cell Immunoglobulin-like receptor(KIR)
(3)単純ヘルペスウィルス感染時の膜融合に利用される Paired Immunoglobulin-like type 2 receptor(PILR)
HIV感染症との関係
ウイルス感染の主たる防御は細胞傷害性T細胞(cytotoxic T lymphocyte:
CTL)やナチュラルキラー(NK)細胞であり、これらを制御する代表的な受容体は、上述のMHCを認識するヒトNK細胞受容体(KIR受容体群やLILR受容体群)である。
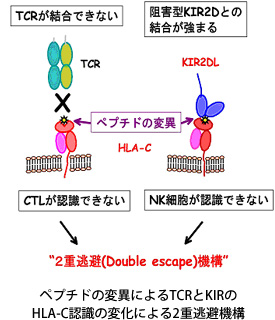
最近、私たちはOxford大学のRowland-Jones博士とTao
Dong博士との共同研究から、MHCに提示されるHIVペプチドの変異がT細胞受容体(TCR)だけでなく、KIR群の認識に影響を与えることを見出し、”2重逃避機構Dual escape model”を提唱しました(AIDS 2009)。
さらに、米グループからLILR群も同様のペプチドによる影響を受けることが報告され(JEM
2009)、大変注目を集めております。私たちは引き続き、その構造的な基盤を明らかにするために、HIV変異ペプチドを提示したMHCとKIR群あるいはLILR群との複合体の結晶構造解析を進めています。
これにより、HIV特異的CTLやNK細胞を活性化できるペプチドエイズワクチンを設計する基盤を構築し、治療へと貢献することを目指します。
(2)主要組織適合性複合体(major histocompatibility complex, MHC)
ヒトMHCクラスIは自己・非自己を認識する免疫系において中心的な役割を持つ分子で、T細胞受容体だけでなく、多くのペア型受容体に結合し、免疫細胞のシグナル伝達に関与しています。 私達は、ペア型受容体のリガンドとしてのMHCクラスI分子に着目しています。
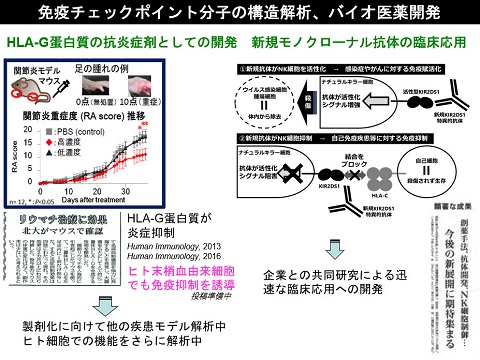
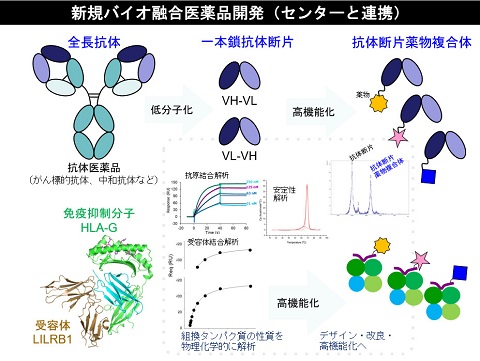
HLA-G
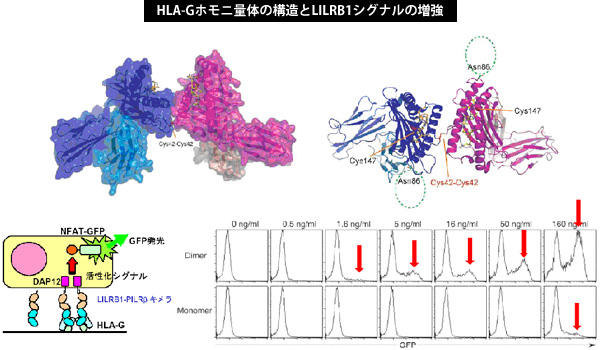
HLA-Gは胎盤・胸腺・腫瘍細胞などの組織特異的に発現する非古典的MHCクラスIのひとつです。妊娠時の胎盤では胎児が母体の免疫を逃れるためにHLA-Gを発現して免疫抑制を誘導していることや、最近では、制御性T細胞がHLA-Gを発現し、免疫抑制機能を発揮していることが分かってきました。
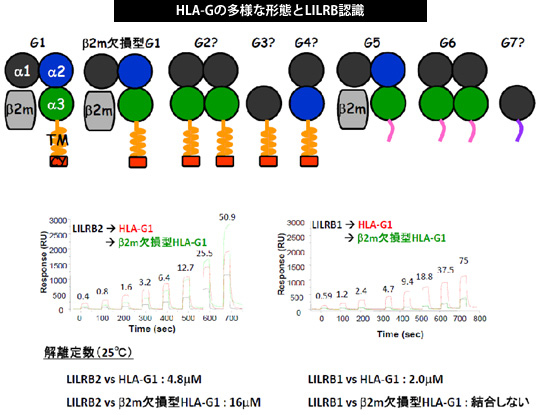
私達は、HLA-Gが生体内で二量体を形成することによって単量体に比べてより効果的に抑制シグナルを伝達していることを立体構造解析、受容体との相互作用解析、細胞内シグナル解析によって明らかにしました(JBC
2006)。 また、HLA-Gが持つ多様な形態に着目し、これらの形態の有する機能及び構造について明らかにしていく事に取り組んでいます。(一部はJoan
Hunt博士(Kansus大学)共同研究)さらに、HLA-Gの免疫抑制機能を利用した副作用の少ない天然の免疫制御蛋白質製剤を目指して、in vivoのレベルまで研究を進めています。
HLA-B27
HLA-B27はリウマチ性自己免疫疾患である強直性脊椎炎との関連が遺伝的解析および動物実験の結果から知られています。
私達は、HLA-B27がHLA-Gに類似した異常な分子形態であるb2mフリーのホモ二量体を形成することに着目し、強直性脊椎炎発症メカニズムへの関与を分子レベルで明らかにしようとしています。(Paul
Bowness博士(Oxford大学)共同研究)
(3)その他
免疫関連細胞表面受容体(KLRG1、CD160、NKRP1など)について構造および機能解析を行っています。
受容体研究のための手法
当研究室では、糖鎖付加や分子内ジスルフィド結合の問題や大変弱い相互作用などの生化学解析および立体構造解析に困難な点が多い免疫系細胞表面受容体の細胞外ドメインを研究するための特化した方法を早くから導入しており、多面的な研究が可能です。
(1)発現系の選択
大腸菌での発現する場合、可溶性蛋白質として発現されるものには限りがあるため、私達は細胞表面受容体の多くを封入体として発現させ、リフォールディング(希釈法)を行っています。
リフォールディングによって、単一ポリペプチド鎖からなる分子だけではなく、MHC重鎖、b2m、ペプチドの3者複合体であるMHCクラスI分子も安定性の高い蛋白質として調製することができます。
また、構造や機能に糖鎖修飾が必須な蛋白質に関しては、ヒトHEK293細胞やカイコ個体を用いた発現系を確立しています。
(図:発現系の選択)
(図:カイコ)
(2)相互作用解析
生体分子間の相互作用を明らかにするために、主に表面プラスモン共鳴(surface plasmon resonance: SPR)法を用いた相互作用解析を行っています。SPRという物理現象を観察することによって、標識することなくリアルタイムに蛋白質、核酸、ペプチド、糖鎖、脂質、細胞などさまざまな生体分子の相互作用を解析することができます。 相互作用解析によって、生体分子同士が特異的に結合するのか、速度論的、熱力学的にどのようにどのくらいの強さで相互作用するのか明らかにすることができます。また、SPR法によって、阻害剤の選択やリガンドフィッシングも可能です。
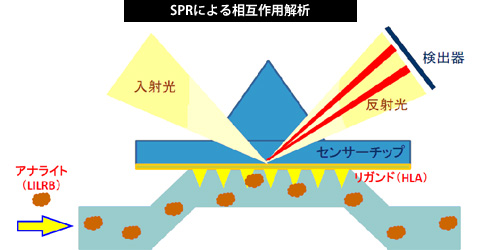
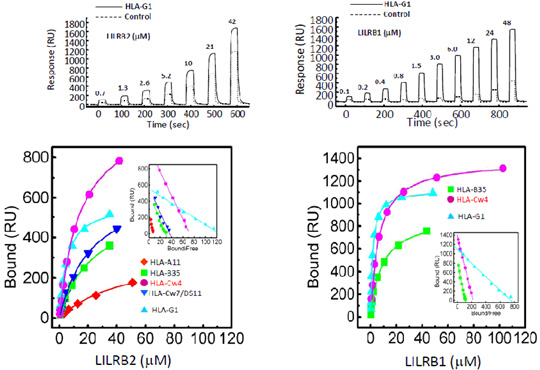
そのほかの手法として、当研究室ではNMR (nuclear magnetic resonance)法を用いた分子間相互作用部位の同定や蛍光相関分光法を用いた相互作用解析、ITC (Isothermal Titration Calorimeter)による熱力学解析も行っています。